V Čechách i ve světě bylo vydáno velké množství různých periodických soustav prvků. Jejich rozdílnost, neúplnost a bohužel někdy i chyby v nich vedly autory právě k celému projektu KTaP plakáty. K sestavení periodické soustavě prvků bylo přistupováno s maximální pečlivostí, zdroje informací a zásady zpracování PSP jsou uveden níže na této stránce. Dále je shrnuta zajímavá historie PSP a třídění prvků.
Periodická soustava prvků, někdy též nazývána tabulka prvků uspořádává chemické prvky podle jejich rostoucího protonového čísla. Tuto soustavu vytvořil ruský chemik Dimitrij Ivanovič Mendělejev v roce 1869. V tabulce jsou prvky řazeny ve sloupečcích, zvaných skupiny a v horizontálních řadách označovaných jako periody. Většina důležitých údajů o chemických prvcích je již uvedena na plakátech, hlavně pak na plakátu určeném pro střední školy. Na internetu lze doporučit krásně a velice rozsáhle zpracovanou elektronickou periodickou soustavu prvků v češtině s vyčerpávajícím popisem všech prvků na prvky.com nebo interaktivní PSP Královské chemické společnosti v angličtině, kde je o jednotlivých prvcích ještě více informací.
S názvy prvků není velký problém, jsou dané a relativně ustálené. Značky a mezinárodní názvy se řídí oficiálními názvy Mezinárodní unie pro čistou a užitnou chemii IUPAC. Všech 118 prvků je pojmenováno od konce roku 2016. České názvy se též v různých zdrojích neliší a jsou ustálené, jedinou výjimkou je moskovium, kde se užívá i v češtině mezinárodní název moscovium, v naší PSP je počeštěná verze.
Uvádění objevitelů prvků nemá pro chemii valný význam, je však velmi zajímavé z historického hlediska. Prakticky ke každému prvku se váže příběh, jak byl objeven, vyroben a pojmenován. Uveďme alespoň dva příklady. V roce 1899 detekovali britští vědci Ernest Rutherford a Robert Owens radioaktivní plyn uvolňovaný thoriem. V tom samém roce tento neznámý plyn pozorovali i manželé Pier a Marie Curieovi. Jednalo se o radon, který však popsal a hlavně pojmenoval německý fyzik a chemik Friedrich Ernst Dorn v roce 1900. Curieovi a Dorn objevili izotop 222Ra a Rutherford s Owensem izotop 220Ra. O 8 let později shromáždili britští vědci William Ramsay a Robert Whytlaw-Gray dostatek radonu, aby mohli stanovit jeho vlastnosti. Za objevitele se považuje Friedrich Ernst Dorn ale na objevu se podílelo 7 vědců. V naší PSP zpravidla najdete jméno výzkumníka uvedeného v přehledu Královské chemické společnosti. Pokud je jich v přehledu společnosti uvedeno více, v tabulce máme jméno prvního z nich. Neuvádíme a kol. Praseodym s neodymem vlastenecky připisujeme Bohuslavu Braunerovi. U Marie Curie uvádíme i rodné jméno Skłodowská v polské transkripci a společně s Marguerite Pereyovou ji česky přechylujeme. U moskovia, tennessinu a oganessonu uvádíme více laboratorří. U prvku nihonium je uveden RIKEN, což není jméno výzkumníka, ale zkratka japonského výzkumného institutu, jehož vědci objevu nihonia dosáhli.
S roky objevu je situace podobně složitá jako s objeviteli. Prvky, které se vyskytují přirozeně v přírodě jako elementární znali již pralidé i když si to neuvědomovali, u těch uvádíme jako rok objevu pravěk (od počátku věků do r. -3000). Vymezení starověku je historicky obtížné, liší se podle zeměpisného umístění, např. v době starověkých říší v Mezopotámii nebo Egyptě ještě v Evropě panoval pravěk. V našich PSP uvádíme rok objevu starověk u těch prvků, které byly objeveny/vyrobeny mezi lety -3000 a 476. Do období středověku (476 – 1492) spadá pouze objev arsenu, u kterého je středověk i uveden. Později objevené prvky již mají uveden konkrétní letopočet. Ten vždy náleží objeviteli, který je zapsán vedle.
Tyto prvky označené symbolem baňky. se přirozeně nevyskytují v přírodě ani ve sloučeninách. Sporné může být neptunium a plutonium, které se vyskytují v radioaktivním spadu po termojaderných výbuších a není vyloučena jejich existence i jinde ve vesmíru. Z pohledu planety Země je však jejich přítomnost bez antropogenního působení vyloučena, proto jsou v naší PSP uvedeny též jako uměle připravené.
Na rozdíl od většiny PSP neuvádíme popisek radioaktivní, ale záměrně Známy jen nestabilní izotopy. Dalo by se říci, že téměř každý prvek je radioaktivní, existují totiž i jeho nestabilní izotopy, které se rozpadají. Pokud tedy alespoň jeden izotop daného prvku je stabilní, označení v naší PSP nemá.
Elektronegativita je schopnost atomů (ne)přitahovat vazebné elektrony, čím vyšší elektronegativita, tím prvek lépe přitahuje vazebné elektrony. Tato veličina nemá jednotky a její velikost byla dána konvencí - elektronegativita uhlíku je počítána 2,2. Nejčastěji je používána Paulingova stupnice, která je i v naší PSP. Existují i jiné, proto se mnohé periodické soustavy prvků v tomto údaji velmi liší. U nevazných prvků nebo prvků prakticky nevazných není elektronegativita uváděna. Hodnoty vycházejí z tohoto zdroje
Určení elektronové konfigurace není většinou problém a jednotlivý zdrojích se prakticky neliší. V naší PSP je uváděn od beryllia dál zkrácený zápis elektronové konfigurace pomocí vzácného plynu.
Jejich určení je prakticky nemožné, otázkou je, co znamená „nejčastější“. Jsou převzata tato data.
Ar je podíl klidové hmotnosti atomu a atomové hmotnostní konstanty (1,661·10-27 kg), jinými slovy relativní atomová hmotnost nám říká, kolikrát je daný prvek těžší než 1/12 klidové hmotnosti nuklidu uhlíku 12C. V naší PSP jsou užita data z technické zprávy IUPAC z roku 2021. relativní atomové hmotnosti jsou zaokrouhlena na 4 platné cifry, u nejvýznamnějších prvků pak na 6 platných cifer.

Za zakladatele chemie jako vědního oboru je považován anglický přírodovědec Robert Boyle (1627 – 1691). V této době bylo známo 12 prvků a jejich třídění bylo veskrze zbytečné. V 18. a 19. století šel chemický výzkum sice pomalu, ale jistě. Lidé již uměli stanovit relativní atomové hmotnosti (hmotnostní čísla) a roku 1858 významný italský chemik, laureát Nobelovy ceny, Stanislao Cannizaro publikoval soubor 60 prvků, které po seřazení podle rostoucích hmotnostních čísel vykazovaly periodicky se opakující vlastnosti. Na něj navázal 1857 francouzský organický chemik Jean-Babtiste Dumas publikací tabulky obsahující 32 prvků v 8 sloupcích. Dalším pokusem o třídění chemických prvků byla roku 1864 tabulka německého přírodovědce Julia Lothara Meyera s 28 prvky seřazenými podle počtu vazeb, které jsou schopny tvořit. Zásadní zlom v třídění chemických prvků však představoval v roce 1869 periodický zákon formulovaný ruským chemikem Dmitrijem Ivanovičovem Mendělejevem a následné vytvoření periodické soustavy prvků, kterou po dvou letech ještě sám vylepšil. Celkem Mendělejevova soustava obsahovala 63 tehdy známých prvků a další 10 předpovězených prvků. U čtyřech z nich (skandia, galia, germania a polonia) předpověděl velmi přesně jejich vlastnosti. Zpočátku nebyl odbornou veřejností periodický systém prvků formulovaný Mendělejevem jednoznačně přijat, jedním z největších propagátorů Mendělejevova učení byl český chemik, objevitel neodymu a praseodymu, Bohuslav Brauner.
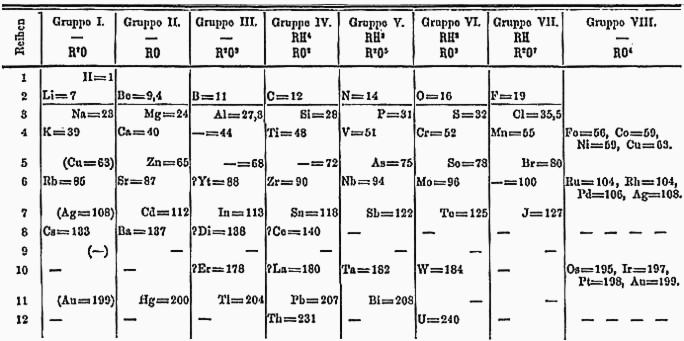
Na první pohled je Mendělejevova tabulka z roku 1871 značně odlišná od dnešního vyobrazení, při bližším prohlédnutí se ale tak moc neliší. Skupiny I. Až VIII. jsou uvedeny i v ní, jen nejsou rozděleny na A a B. Například v první skupině jsou uvedeny všechny „dnešní“ prvky až na francium a roentgenium. Další zajímavostí je předpovězení germania, které se v Mendělejevově soustavě vyskytuje ještě nepojmenované pod křemíkem, ale už se správně stanovenou atomovou hmotností 72. Další vlastnosti germania a jeho sloučenin, které velice přesně Mendělejev předpověděl jsou v tabulce níže.
| Vlastnost | Mendělejevova předpověď | Skutečnost |
|---|---|---|
| Relativní atomová hmotnost | 72 | 72,63 |
| Hustota (g·mol-1) | 5,5 | 5,35 |
| Oxid | EsO2 (oxid eka-siliciničitý) | GeO2 (oxid germaničitý) |
| Hustota oxidu (g·mol-1) | 4,7 | 4,703 |
| Organická sloučenina | tetraethylekacilicium | tetraethylgermanium |
| -její teplota varu (°C) | 160 | 163-165 |
| -její hustota (g·mol-1) | 0,96 | 0,99 |
Prvky se třídí podle mnohých kritérií, jedno z nejvýznamnější je podle kovového charakteru na kovy, nekovy a polokovy, toto třídění i na našem plakátu. Mezi kovy řadíme chemické prvky, které jsou tepelně i elektricky vodivé, elektropozitivní, kujné, tažné prvky a mají kovový lesk. Nekovy nemají všechny tyto vlastnosti. Např. uhlík je elektricky vodivý, ale není tažný. Polokovy jsou přechodem mezi kovy a nekovy, jejich vymezení je sporné.
Dále lze prvky třídit do bloků na s-, p-, d- a f-prvky. I. a II. A skupina patří do bloku s, I. Až VIII. B skupina do bloku d, III. až VIII. B skupina do bloku p a lanthanoidy (prvky s protonovým čísly 57-71) s aktinoidy (prvky s protonovým čísly 90-103) do bloku f. Význam tohoto třídění je v umístění elektronů těchto prvků s nejvyšší energií, např. s-prvky mají elektrony s nejvyšší energií v orbitalu s, prvky z p-bloku v orbitale p atd…
Dále se uvádí třídění prvků na přechodné, nepřechodné a vnitřně přechodné prvky. Nepřechodné prvky jsou zároveň prvky bloků s a p, přechodné prvky pak spadají do bloku d s výjimkou prvků II. B skupiny. Prvky bloku f se poté označují jako vnitřně přechodné prvky.
Prvky lze též třídit podle jejich skupenství za laboratorních podmínek (25°C, 101325 Pa) na pevné, plynné a kapalné. Většina prvků je za laboratorních podmínek pevná, 11 prvků (pokud se nepočítá sporný Oganesson) plynných a pouze dva prvky – rtuť a brom jsou kapalné. Gallium s teplotou tání 29,8 °C se kapalným prvkům blíží.
Často se setkáváme s pojmenováním jednotlivých skupin prvků zvláštními názvy, zpravidla danými historicky. Tyto názvy se používají velmi často a je dobré o nich mít přehled. Prvky I. A skupiny vyjma vodíku se nazývají alkalické kovy. Prvky II. A skupiny kovy alkalických zemin, prvky I. B skupiny pak jednoduše jako kovy skupiny mědi. V VIII. B skupině je obsaženo 9 prvků, které se nazývají triády. Železo, kobalt a nikl je triáda železa, ruthenium, rhodium a palladium triáda platinových kovů a osmium, iridium, platina pak triáda těžkých platinových kovů. VI. A skupina se označuje jako chalkogeny, protože prvky v ní označené tvoří rudy (hlavně kyslík a síra). Prvky VII. skupiny se nazývají chalkogeny a prvky VIII. a skupina jako vzácné (netečné, inertní) plyny. Zvláštní názvy však nemají jen skupiny prvků, ale také části period. Již výše bylo zmíněno, že prvky 57 až 71 jsou lanthanoidy a prvky 89 až 103 zase aktinoidy. Prvky na konci periodické soustavy (od uranu) se nazývají transurany.