Pro zvládnutí jednoduchého anorganického názvosloví byste měli znát:
- Názvoslovné předpony (ný-, natý-, itý-, ičitý-, ičný-/ečný-, ový-, istý-, ičelý-)
- Názvy prvků
- Co znamená oxidační číslo
Oxidační číslo
Vytvořil JMaker, 3.1.2022
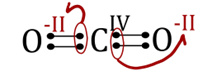 Elektrický náboj, který by se nacházel na atomu prvku, kdybychom elektrony každé vazby přidělili elektronegativnějšímu prvku. Například oxid uhličitý CO2 se skládá z jednoho atomu uhlíku a dvou atomů kyslíku. Atomy jsou vzájemně spojeny dvojnými vazbami. Jelikož má uhlík nižší elektronegativitu (2,55) než kyslík (3,44), náleží elektrony z vazeb kyslíkům. Oba kyslíky mají tedy v oxidu uhličitém formální náboj -2 a uhlík má formální náboj +4. Celkové oxidační číslo molekuly je vždy rovno nule! Stejně tak oxidační číslo prvku je také nula. Vodík má ve většině sloučenin oxidační číslo +1. Oxidační čísla prvků v různých skupinách sloučenin jsou zapsána v nadpisech. V následujícím textu budeme oxidační čísla značit římskými číslicemi.
Elektrický náboj, který by se nacházel na atomu prvku, kdybychom elektrony každé vazby přidělili elektronegativnějšímu prvku. Například oxid uhličitý CO2 se skládá z jednoho atomu uhlíku a dvou atomů kyslíku. Atomy jsou vzájemně spojeny dvojnými vazbami. Jelikož má uhlík nižší elektronegativitu (2,55) než kyslík (3,44), náleží elektrony z vazeb kyslíkům. Oba kyslíky mají tedy v oxidu uhličitém formální náboj -2 a uhlík má formální náboj +4. Celkové oxidační číslo molekuly je vždy rovno nule! Stejně tak oxidační číslo prvku je také nula. Vodík má ve většině sloučenin oxidační číslo +1. Oxidační čísla prvků v různých skupinách sloučenin jsou zapsána v nadpisech. V následujícím textu budeme oxidační čísla značit římskými číslicemi.
Křížové pravidlo
Při tvorbě vzorců oxidů lze použít tzv. křížové pravidlo. Postup je následující:
- Napíše se oxidační čísla nad jednotlivé prvky, nad kyslík -II a nad druhý prvek číslo podle názvoslovné přípony
- Křížově se pod druhý prvek napíše stejné číslo arabskou číslicí, tato čísla se obě píší kladná!
- Pokud lze arabská čísla krátit, zkrátí se
- Jedničky se do konečného vzorce nepíší
Oxidy O-II
 Jedná se o dvouprvkové sloučeniny kyslíku s elektropozitivnějším prvkem. Dříve se označovaly jako kysličníky. Příklady oxidů jsou v tabulce níže, všimněte si, že oxidační číslo celé sloučeniny je rovno nule
Jedná se o dvouprvkové sloučeniny kyslíku s elektropozitivnějším prvkem. Dříve se označovaly jako kysličníky. Příklady oxidů jsou v tabulce níže, všimněte si, že oxidační číslo celé sloučeniny je rovno nule
Například výpočet oxidačního čísla pro Al2-IIIO3-II - je: 2*3 + 3*-2 = 0
Příklady oxidů podle oxidačního stavu
| Oxidační stav | Poměr | Příklad |
| I | 2:1 | K2O - oxid draselný |
| II | 1:1 | CaO - oxid vápenatý |
| III | 2:3 | Al2O3 - oxid hlinitý |
| IV | 1:2 | PbO2 - oxid olovičitý |
| V | 2:5 | I2O5 - oxid jodičný |
| VI | 1:3 | SO3 - oxid sírový |
| VII | 2:7 | Mn2O7 - oxid manganistý |
| VIII | 1:4 | XeO4 - oxid xenoničelý |
Sulfidy S-II
Sulfidy jsou dvouprvkové sloučeniny síry s elektropozitivnějším prvkem. Jelikož má síra v sulfidech stejné oxidační číslo jako kyslík v oxidech, tvoří se jejich názvy a vzorce obdobným způsobem. Ve starší literatuře se můžou být sulfidy pojmenovány výrazem sirníky.
Příklady sulfidů podle oxidačního stavu
| Oxidační stav | Poměr | Příklad |
| I | 2:1 | Na2O - sulfid sodný |
| II | 1:1 | PbS - sulfid olovnatý |
| III | 2:3 | In2O3 - sulfid inditý |
| IV | 1:2 | CS2 - sulfid uhličitý |
| V | 2:5 | P2S5 - sulfid fosforečný |
| VI | 1:3 | MoS3 - sulfid molybdenový |
| VII | 2:7 | Re2S7 - sulfid rhenistý |
| VIII | 1:4 | OsS4 - sulfid osmičelý |
Halogenidy X-I
Halogenidy jsou dvouprvkové sloučeniny halogenů (flouru, chloru, jódu, bromu) s elektropozitivnějšími prvky, též se jedná o soli halogenvodíkových kyselin. Jedná se tedy o fluoridy, chloridy, jodidy a bromidy. Oxidační číslo halogenu je vždy -I, oxidační stav elektropozitivnějšího prvku v halogenu tedy přímo odpovídá názvoslové příponě.
Příklady halogenidů podle oxidačního stavu
| Oxidační stav | Poměr | Příklad |
| I | 1:1 | NaCl - chlorid sodný |
| II | 1:2 | CaF2 - fluorid vápenatý |
| III | 1:3 | AlI3 - jodid hlinitý |
| IV | 1:4 | SiBr4 - bromid křemičitý |
| V | 1:5 | PCl5 - chlorid fodforečný |
| VI | 1:6 | SF6 - fluorid sírový |
| VII | 1:7 | MnCl7 - chlorid manganistý |
| VIII | Není znám |
Hydroxidy (OH) -I
Hydroxidy jsou tříprkové sloučeniny, kdy jako aniont vystupuje skupina (OH)-I. Formálně vznikají odtržením jednoho atomu vodíku od vody. Maximální oxidační číslo třetího atomu (kationtu) je v hydroxide rovno čtyrem. Dříve se označovaly jako louhy.
Hydridy H -I
Hydridy jsou dvouprkové sloučeniny vodíku. Jsou to jediné významné sloučeniny, ve kterých se vodík vyskytuje v oxidačním stavu -I (většinou se vodík vyskytuje v oxidačním stavu -I). Lze je rozdělit na dvě hlavní skupiny: Iontové hydridy a kovalentní hydridy.
Iontové hydridy
Iontoé hydridy jsou sloučeninami vodíky s elektropozitivními prvky (zpravidla alkalickými kovy a kovy alkalických zemin. Název se skládá ze dvou slov, prvnímje podstatné jméno hydrid a druhým je přídavné jméno s příslušnou názvoslovnou příponou. Z povahy prvků I. a II. A skupiny se vyskytuje jen v oxidačních stavech +I a +II.
Příklady hydridů podle oxidačního stavu
| Oxidační stav | Poměr | Příklad |
| I | 1:1 | KH - hydrid draselný |
| II | 1:2 | MgH2 - hydrid hořečnatý |
Kovalentní hydridy
Bezkyslíkaté kyseliny HX
Kyslíkaté kyseliny HMO
Soli kyslíkatých kyselin
 Elektrický náboj, který by se nacházel na atomu prvku, kdybychom elektrony každé vazby přidělili elektronegativnějšímu prvku. Například oxid uhličitý CO2 se skládá z jednoho atomu uhlíku a dvou atomů kyslíku. Atomy jsou vzájemně spojeny dvojnými vazbami. Jelikož má uhlík nižší elektronegativitu (2,55) než kyslík (3,44), náleží elektrony z vazeb kyslíkům. Oba kyslíky mají tedy v oxidu uhličitém formální náboj -2 a uhlík má formální náboj +4. Celkové oxidační číslo molekuly je vždy rovno nule! Stejně tak oxidační číslo prvku je také nula. Vodík má ve většině sloučenin oxidační číslo +1. Oxidační čísla prvků v různých skupinách sloučenin jsou zapsána v nadpisech. V následujícím textu budeme oxidační čísla značit římskými číslicemi.
Elektrický náboj, který by se nacházel na atomu prvku, kdybychom elektrony každé vazby přidělili elektronegativnějšímu prvku. Například oxid uhličitý CO2 se skládá z jednoho atomu uhlíku a dvou atomů kyslíku. Atomy jsou vzájemně spojeny dvojnými vazbami. Jelikož má uhlík nižší elektronegativitu (2,55) než kyslík (3,44), náleží elektrony z vazeb kyslíkům. Oba kyslíky mají tedy v oxidu uhličitém formální náboj -2 a uhlík má formální náboj +4. Celkové oxidační číslo molekuly je vždy rovno nule! Stejně tak oxidační číslo prvku je také nula. Vodík má ve většině sloučenin oxidační číslo +1. Oxidační čísla prvků v různých skupinách sloučenin jsou zapsána v nadpisech. V následujícím textu budeme oxidační čísla značit římskými číslicemi.
 Jedná se o dvouprvkové sloučeniny kyslíku s elektropozitivnějším prvkem. Dříve se označovaly jako kysličníky. Příklady oxidů jsou v tabulce níže, všimněte si, že oxidační číslo celé sloučeniny je rovno nule
Jedná se o dvouprvkové sloučeniny kyslíku s elektropozitivnějším prvkem. Dříve se označovaly jako kysličníky. Příklady oxidů jsou v tabulce níže, všimněte si, že oxidační číslo celé sloučeniny je rovno nule