Obecně lze na chemické reakce nahlížet ze dvou různý hledisek, za prvé k jakým reakcím dochází a za druhé jak tyto reakce probíhají. Uvádějí se čtyři základní typy chemických reakcí: substituce, eliminace, adice a molekulový přesmyk nebo zkráceně přesmyk.
Během substituce je funkční skupina (nebo atom) v molekule nahrazen jinou funkční skupinou. Dělí podle počtu molekul, které reagují na monomolekulární a bimolekulární. Další (a významnější dělení) je podle mechanismu reakce na nukleofilní substituci SN, Elektrofilní substituci SE a substituci radikálovou SR. Platí, že během substituce se nemění násobnost vazeb substrátu. Příkladem substituce je třeba hydrolýza (reakce s vodou) chlorethenu z plakátu nebo reakce brombutanu s jodidem sodným za vzniku jodbutanu a bromidu sodného.

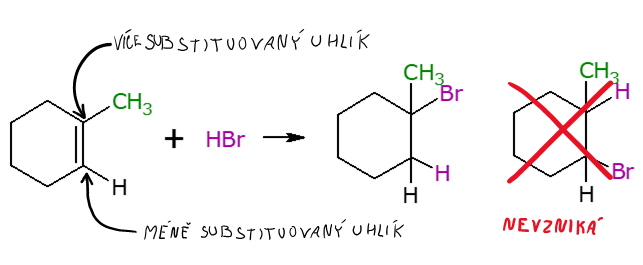
Adicím podléhají nenasycené alifatické nebo cyklické sloučeniny. Často ze dvou reaktantů vzniká jediný, zpravidla nenasycený produkt. Typickým příkladem je halogenace alkenu na dihalogenalkan (uvedena na plakátu) nebo halogenace alkenů či alkynů halogenvodíkem za vzniku halogenalkanu nebo halogenalkenu. S halogenací souvisí Markovnikovo pravidlo, které se týká právě adice halogenvodíku na nenasycený uhlovodík a zní: Při adici halogenvodíku na alken se atom halogenu váže na vícesubstituovaný atom uhlíku. Halogen se váže na vícesubstituovaný uhlík. Markovnikovo pravidlo lze demonstrovat například na reakci 1-methylcyklohexenu s bromovodíkem za vzniku 1-brom-1-methylcyklohexanu, potenciální druhý produkt 1-brom-2-methylcyklohexan vůbec nevzniká, říkáme, že elektrofilní adice je 100 % regioselektivní. Dalšími halogenacemi jsou hydratace (adice vodíku) nebo hydratace (adice vody).
Eliminace je opak adice, někdy je nazývána jako snižování nasycenosti. Při eliminačních reakcích vznikají násobné vazby a zároveň se odštěpují (eliminují) molekuly substituentu. Eliminace bývají často urychlovány přítomností katalyzátorů. Tyto reakce lze jednoduše dělit na eliminaci E2 bimolekulární a eliminaci monomolekulární E1.
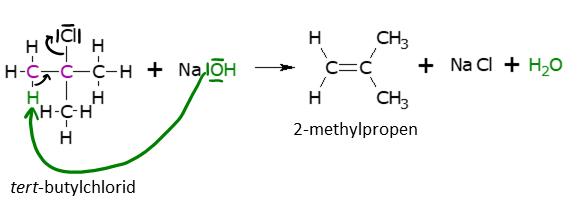
Při bimolekulární eliminaci jsou v nejpomalejším kroku (nejpomalejší krok je kro určující rychlost chemické reakce) zapojeny oba reaktanty. Mechanismus reakci si vysvětlíme na reakci terc-butylchloridu s hydroxidem sodným. K této reakci jsou potřeba silné nukleofily, v tomto případě je jím hydroxidový anion v hydroxidu sodném. Mechanismus E2 má vlastně jen jeden krok, během něho se dějí tři různé procesy: 1. tvoří se vazba mezi nukleofilem a vodíkem 2. mění se hybridizace u fialově zakreslených uhlíků z sp2 na sp3 a za 3. se štěpí vazba C—Cl. Výsledkem této reakce je vznik nenasyceného 2-methyl propenu, vody a hydroxidu sodného
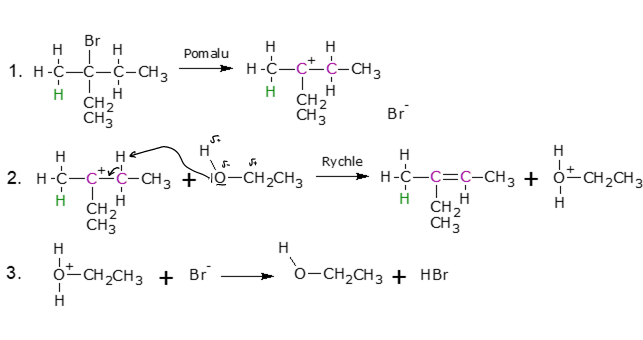
Mechanismus eliminace monomolekulární si vysvětlíme na příkladu reakce 2-brom-2-ethypentanu s ethanolem. E1 reakce má na rozdíl od E2 více kroků. První krok je velmi pomalý (rychlost určující) a podílí se na něm jen jeden reaktant, proto eliminace monomolekulární. V tomto prvním kroku se dlouhá, slabá a polární vazba C—Br v halogenalkanu štěpí a pomalu vzniká relativně stabilní terciární karbokation. Ve druhém, rychlém kroku dochází k deprotonizaci karbokatintu, ethanol je slabou bazí a je schopný si přitáhnout proton ze vzniklého karbokatintu, tím vzniká dvojná vazba a mění se hybridizace fialově označených uhlíků z sp3 na sp2, v posledním kroku zreaguje bromidový anion se vzniklým elektrofilem za vzniku kyseliny chlorovodíkové a ethanolu, výsledným produktem je ale 3-ethylpent-2-en z kroku 2.
Molekulový přesmyk není typická reakce v organické chemii. Z jedné výchozí látky vzniká jeden produkt. Většinou dochází ke vzniku stabulnější látky. Krom spíše ilustračního přsmyku chlorpropanu, který je uveden na plakátu lze zmínit přesmyk prop-1,2-dienu na propyn nebo přesmyk oximu cyklohexanonu na ε-kaprolaktam, tento přesmyk se nazývá Beckmanův a jedná se jeden z kroků průmyslově významné výroby silonu.