Organické názvosloví je značně odlišné od názvosloví anorganického. Zároveň je více mezinárodní, nemá tak výrazná česká specifika (ný-, natý-, itý-...). Jako takové je založeno na základní homologické řadě alkanů. Jeho využití je opravdu široké, pro každé se hodí jiný zápis vzorce, proto exituje několk typů vzorců.
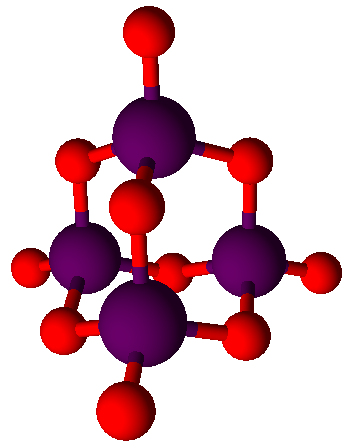
Pro vyjádření elementárního (prvkového) složení a případně i struktury molekuly se využívají chemické vzorce. V anorganické chemii se běžně používají stechiometrické (empirické) vzorce, které vyjadřují poměr počtu atomů v molekule dané chemické sloučeniny. Například oxid hlinitý má stechiometrický vzorec Al2O3, tzn. že na dva atomy hliníku připadají tři atomy kyslíku nebo kyselina dusičná má vzorec HNO3, což znamená, že na jeden atom vodíku připadá jeden atom dusíku a tři atomy kyslíku. U většiny sloučenin za běžných okolností tyto vzorce postačují, k problémům může dojít u sloučenin, které tvoří tzv. dimery, například jedna molekula oxidu fosforečného, viz obrázek vlevo, obsahuje pět atomů fosforu a deset atomů kyslíku, stechiometrický vzorec P2O5 poté není zcela správný a je lepší používat sumární vzorec P4O10. Souhrnně však lze tvrdit, že pro vyjádření většiny anorganických sloučenin stechiometrické vzorce plně postačují. Vzhledem k počtu molekul, množství atomů které tvoří organické sloučeniny a významu jejich struktury je v organické chemii situace značně odlišná. Například ethanol má stechiometrický vzorec C2H6O, ale stejný vzorec má i dimethylether , což je látka značně odlišných vlastností i využití. Ještě horší situace by byla třeba u benzenu, jeho stechiometrický vzorec je CH – na jeden atom uhlíku připadá jeden atom vodíky, o počtu jednotlivých atomů natož o struktuře nám tento vzorec neřekne zhola nic. Zpravidla dochází k rozporu mezi úsporností zápisu a úplností vyjádření struktury molekul, proto se v organické chemii využívá více typů vzorců, konkrétně sumární (molekulové) vzorce, racionální (funkční) vzorce, strukturní (konstituční) vzorce a vzorce čárové.
Vyjadřují skutečný počet atomů v molekule dané chemické sloučeniny. Například benzen má vzorec C6H6 nebo na plakátu uvedený 4-methylhexan-3-ol má sumární vzorec C7H12O. Ani tento vzorec však pro vyjádření struktury molekuly není příliš vhodný, viz výše uvedený problém se vzorcem ethanolu/etheru, používá se okrajově, například při zápisu v textu nebo v tabulkách.
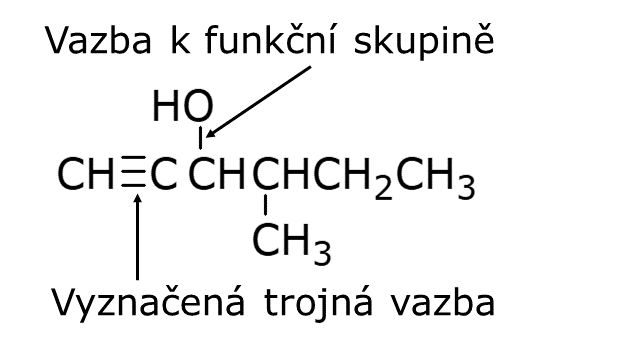
Racionální vzorce jsou v organické chemii často využívány při zápisu chemických reakcí, popisu laboratorního nádobí, poznámek při laboratorní práci a podobně. V těchto vzorcích se znázorňují jednotlivé funkční skupiny. Jedná se o rozumný kompromis mezi podrobným zobrazením dané molekuly a úsporou místa na papíře, monitoru, baňce, tabuli… Zápis provádíme tak, že napíšeme značku pro uhlík C a k ní příslušný počet vodíků, pokud se k danému uhlíku váže nějaká funkční skupina, zakreslí se od uhlíku vazba a na její konec práce daná funkční skupina, následuje zápis násobné vazby (dvojné nebo trojné) a dalšího uhlíku, ke kterému se opět připisují funkční skupiny. Pokud jsou uhlíky v základním řetězci vázány jen jednoduchou vazbou, tak se tato nezapisuje a hned se píše další uhlík. Existují jeho dvě varianty základní a zkrácená. Při zápisu zkrácené varianty se píše opakující se skupina, zpravidla CH2 do závorky a do dolního indexu za závorku se číslicí značí počet opakování takové skupiny, viz obrázek níže. Zkrácená varianta je vhodná u delších alifatických řetězců.
CH3CH2CH2CH2CH2CH2—OH
Základní varianta zápisu
CH3(CH2)4CH2—OH
Zkrácená varianta zápisu
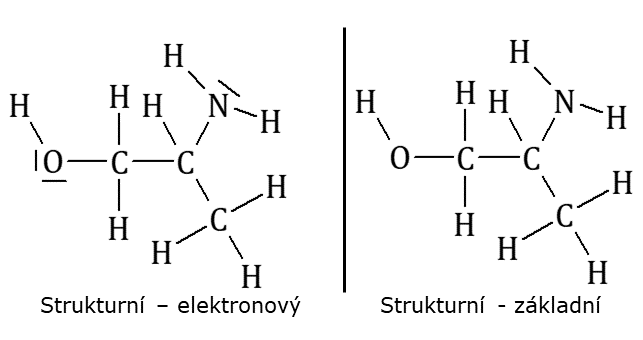
Strukturní vzorce jsou nepodrobnějším vyjádřením podoby molekuly. Jsou v nich zobrazeny vazby mezi všemi atomy. Existují, podobně jako racionální vzorce, ve dvou variantách, klasické a elektronové, kdy se navíc k daným prvků připisují volné elektronové páry. Každý volný elektronový pár je vyznačen čárkou, dvěma tečkami, popř. jiným způsobem zápisu. Nevýhoda strukturních vzorců spočívá v jejich rozsáhlosti a s tím spojeným delším časem zapsání. Ani u strukturních však vzorců není vyjádřen tvar molekuly.
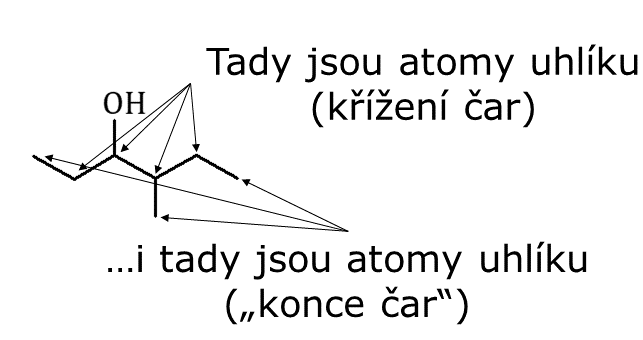
Relativně často se používají i čárové vzorce. V těchto vzorcích se nepíší žádné atomy a naopak se zapisují všechny chemické vazby. Jejich výhodou je relativně rychlý zápis a naznačení vazebných úhlů v molekule. Nevýhodou může být horší přehlednost pro jedince méně chemicky zdatné a obtížnější zápis mechanismu chemických reakcí. Platí pravidlo, že na konci každé čáry, v ohybu nebo v místě, kde se čáry kříží je uhlík. Vodíky se vůbec v čárových vzorcích nevyskytují a ostatní prvky se značí jejich symboly. Další informace lze naléz například v tomto materiálu Přírodovědecké fakutly UK.
Homologická řada v chemii je tvořena sloučeninami o stejném obecném vzorci, existuje homologická řada alkanů, alkenů, alkynů, alkoholů, cykloalkanů atd. Při odvozování názvů v organické chemii nebo při zápisu vzorců je nutné znát homologickou řadu alkanů, proto se označuje jako základní. Na homologických řadách se dobře vyjadřuje například vliv délky řetězce na fyzikální veličiny, jako jsou teplota tání nebo varu. Zpravidla se uvádí jen prvních deset alkanů (plakát), níže je tabulka prvních dvaadvaceti alkanů se zápisem skupenství a teplot tání i varu. Z tabulky je dobře patný vliv délky řetězce na teploty tání a varu, slouží pro odvození názvů všech významných alkanů a zároveň ukazuje skupenství jednotlivých alkanů za standartních podmínek.
| Název alkanu | Sumární vzorec | Bod tání [°C] | Bod varu [°C] |
|---|---|---|---|
| Methan (g) | CH4 | -184 | -161 |
| Ethan (g) | C2H6 | -172 | -88 |
| Propan (g) | C3H8 | -187 | -42 |
| Butan (g) | C4H10 | -135 | 0 |
| Pentan (l) | C5H12 | -131 | 36 |
| Hexan (l) | C6H14 | -96 | 69 |
| Heptan (l) | C7H16 | -90 | 98 |
| Oktan (l) | C8H18 | -56 | 125 |
| Nonan (l) | C9H20 | -51 | 151 |
| Dekan (l) | C10H22 | -30 | 174 |
| Undekan (l) | C11H24 | -26 | 196 |
| Dodekan (l) | C12H26 | -10 | 216 |
| Tridekan (l) | C13H28 | -5 | 234 |
| Tetradekan (l) | C14H30 | 6 | 253 |
| Pentadekan (l) | C15H32 | 10 | 269 |
| Hexadekan (l) | C16H34 | 18 | 287 |
| Heptadekan (l) | C17H36 | 22 | 302 |
| Oktadekan (s) | C18H38 | 29 | 317 |
| Nonadekan (s) | C19H40 | 33 | 330 |
| Ikosan (s) | C20H42 | 37 | 343 |
| Henikosan (s) | C21H44 | 41 | 357 |
| Dokosan (s) | C22H46 | 42 | 369 |
Někdy také označována jako konfigurační izomerie, optická izomerie nebo E/Z izomerie popisuje prostorové uspořádání dvou stereoisomerů. Nejčastěji popisuje uspořádání v okolí dvojné vazby, označují se tak ale i isomery substituovaných cyklických sloučenin nebo uspořádání ligandů v komplexních sloučeninách. Z pohledu jedné dvojné vazby existují dva stereoisomery, které se označují jako cis/trans, popř. jako E/Z. cis isomery mají významnější substituenty na stejné straně, v poslední době se dává přednost označení Z (z německého Zusammen – spolu). trans isomery mají významnější substituenty naproti sobě, nově se používá označení E (z německého Entgegen – naproti). Při určování této izomerie se postupuje následovně:
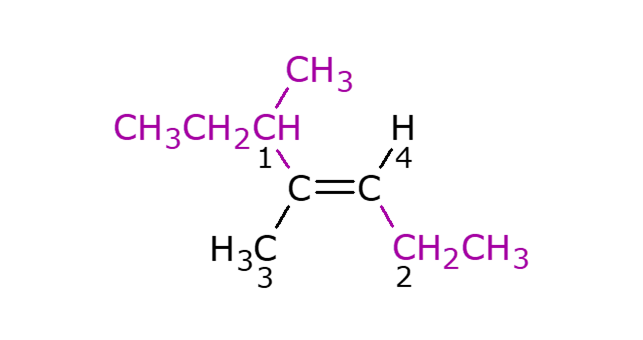 Situace nemusí být vždy tak jednoduchá, jako u but-2-enu, který je na plakátu. Na obrázku vlevo je vzorec 4,5 – dimethylhept – 3 – ynu. K názvu jsme dospěli následovně: na uhlících dvojné vazby jsou umístěny 4 různé substituenty, největší a tudíž nejvýznamnější z nich je 1-methylpropyl, druhý nejvýznamnější je ethyl, třetí nejvýznamnější methyl a nejméně významný je atom vodíku, na obrázku jsou substituenty podle významnosti i očíslovány. Jelikož jsou dva nejvýznamnější substituenty naproti sobě, tak úplný název uhlovodíku je E-4,5–dimethylhept–3–yn resp. trans–4,5–dimethylhept–3–yn.
Situace nemusí být vždy tak jednoduchá, jako u but-2-enu, který je na plakátu. Na obrázku vlevo je vzorec 4,5 – dimethylhept – 3 – ynu. K názvu jsme dospěli následovně: na uhlících dvojné vazby jsou umístěny 4 různé substituenty, největší a tudíž nejvýznamnější z nich je 1-methylpropyl, druhý nejvýznamnější je ethyl, třetí nejvýznamnější methyl a nejméně významný je atom vodíku, na obrázku jsou substituenty podle významnosti i očíslovány. Jelikož jsou dva nejvýznamnější substituenty naproti sobě, tak úplný název uhlovodíku je E-4,5–dimethylhept–3–yn resp. trans–4,5–dimethylhept–3–yn.